 В.И.Кисина
В.И.Кисина
Московская медицинская академия им. И.М.Сеченова, Москва
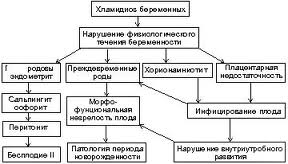
В настоящее время одним из приоритетных направлений дерматовенерологии и смежных специальностей (акушерство-гинекология, урология и др.) является лечение урогенитальной хламидийной инфекции – заболевания, занимающего, по оценкам ВОЗ, второе место после урогенитального трихомониаза среди инфекций, передаваемых половым путем (ИППП). Ежегодно в мире выявляется более 90 млн больных урогенитальным хламидиозом, а затраты на лечение осложнений данной инфекции только в США превышают 4 млрд долларов. При этом частота выделения /C. trachomatis/ у беременных составляет 2 до 6–8%. Инфицирование новорожденных от матерей с хламидийной инфекцией достигает 60–70% с развитием в течение первых 2 нед жизни конъюнктивита и в 1–3 мес пневмонии [1].
В соответствии с современной таксономической классификацией /C. trachomatis/ относится к /Chlamydiales/, семейству /Chlamydia/ceae, включающему 4 рода: /Chlamydia/, /Chlamydophila/, Simkaniaceae, /ParaChlamydiaceae/.
Патогенными для человека считаются следующие виды: /C. trachomatis/, / C. psittaci/, /C. pneumoniae/ и /C. pecorum/.
Основой выделения видов хламидий являются различия в их антигенном строении. Около 60% всех мембранных белков составляет главный белок наружной мембраны (МОМР), при этом МОМР разных видов хламидий содержит видо-, био- и серотипоспецифические участки белка, находящиеся на поверхности элементарных телец (ЭТ). Именно гликозидная часть возбудителя ответственна за инфицирование клетки макроорганизма. Вид /C. trachomatis/ подразделяется на 15 основных сероваров – от А до L. Серовары от А до С характерны для трахомы (конъюнктивит хламидийной этиологии), серовары D–R – для урогенитальной патологии человека (включая такие осложнения, как пневмония и конъюнктивит), серовары L1–L3 выделяются у больных венерической лимфогранулемой.
Описаны две функционально и морфологически различные формы /C. trachomatis/: инфекционные метаболически неактивные ЭТ, приспособленные к внеклеточному существованию, и ретикулярные тельца (РТ), находящиеся внутри клеток, которые подвергаются делению.
Вследствие внутриклеточного паразитирования и неоднократного деления формируется хламидийное включение – колония, содержащая до тысячи микроорганизмов, а затем РТ начинают трансформироваться в ЭТ. Длительность цикла развития /C. trachomatis/ в цитоплазматических включениях составляет 40–72 ч и, как правило, завершается разрывом мембраны включения с поступлением в межклеточное пространство и дальнейшей инвазией новых клеток ЭТ. В случае сохранения жизнеспособности клетки-хозяина хламидийная инфекция характеризуется латентным течением.
При лабораторной идентификации /C. trachomatis/ длительное время предпочтение отдавалось культуральному методу исследования (КИ), позволяющему обнаружить жизнеспособные микроорганизмы. С помощью современных молекулярно-биологических методов исследования продемонстрировано, что чувствительность КИ не превышает 60–80%, а его результаты в значительной степени зависят от выполнения условий получения клинического материала и транспортировки в лаборатории. В то же время метод КИ характеризуется высокой специфичностью, что позволяет рекомендовать его для идентификации /C. trachomatis/ в экстрагенитальных органах и оценки эффективности терапии хламидийной инфекции.
*
Классификация FDA (США) безопасности лекарственных средств у беременных
*
* *
Категория риска
* *
Характеристика
* *
Препарат
А
В контролируемых исследованиях
у женщин не выявлено риска для
плода в I триместре (и нет
доказательств риска в других
триместрах). Возможность
повреждающего действия на плод
представляется маловероятной
B
При изучении репродукции на
животных риска для плода
выявлено не было, а контролируемые
исследования у беременных женщин
не проводились или нежелательные
эффекты (кроме снижения
фертильности) были показаны
в экспериментах на животных, но
их результаты не подтвердились
в контролируемых исследованиях
у женщин в I триместре
беременности (и нет доказательства
риска в других триместрах)
/ /
/Пенициллины: /бензилпенициллин,
ампициллин, амоксициллин,
амоксициллин/клавуланат
/Макролиды: /эритромицин,
азитромицин
/Цефалоспорины: /цефазолин,
цефепим, цефуроксим, цефотаксим,
цефтриаксон
/Карбапенемы: /меропенем
/Нитроимидазолы: /метронидазол,
нитрофурантоин, фосфомицин,
спектиномицин
C
При изучении репродукции на
животных выявлено
неблагоприятное действие
на плод, а адекватных и строго
контролируемых исследований
у беременных женщин не
проводилось, однако
потенциальная польза
лекарственного средства
для беременной может оправдать
его использование. Или
исследования на животных
и адекватные хорошо
контролируемые исследования
у беременных женщин не
проводились
/ /
/Карбапенемы/: имипенем
/Макролиды:/ кларитромицин
/Аминогликозиды: /гентамицин
/Гликопептиды:/ ванкомицин
/Сульфаниламиды/: ко-тримоксазол /Фторхинолоны:/ левофлоксацин,
норфлоксацин, офлоксацин,
ципрофлоксацин
D
Имеются доказательства риска
для плода человека, однако польза
применения у беременных женщин
может превышать риск (например,
если лекарственное средство
необходимо в угрожающей жизни
ситуации или для лечения тяжелого
заболевания, при котором более
безопасные препараты нельзя
использовать или они могут быть
неэффективны)
/ /
/Тетрациклины:/ тетрациклин,
доксициклин
/Аминогликозиды:/ амикацин,
канамицин, нетилмицин,
стрептомицин, тобрамицин
X
В исследованиях на животных или людях выявлены нарушения развития
плода и/или имеются доказательства
риска для плода, основанные на
опыте применения лекарственного
средства у людей. Риск применения
у беременных женщин превышает
любую возможную пользу.
Противопоказаны беременным
и женщинам, которые могут
забеременеть
Основными задачами лечения хламидийной инфекции являются:
**/
* элиминация C. trachomatis,
* разрешение клинических симптомов заболевания,
* предупреждение инфицирования половых партнеров,
* предупреждение инфицирования новорожденных.
/
К некультуральным методам лабораторной диагностики хламидийной инфекции относятся прямая иммунофлюоресценция, иммуноферментный анализ (ИФА), чувствительность которых составляет 50–80%. В связи с тем что антитела к липополисахаридному антигену /C. trachomatis/ могут перекрестно реагировать с липополисахаридами (ЛПС) других грамотрицательных микроорганизмов, имеется высокая вероятность получения ложноположительных результатов при использовании ИФА.
Методы, основанные на амплификации нуклеиновых кислот, превосходят по своей чувствительности другие диагностические методы, включая КИ, и позволяют идентифицировать минимальное количество ЭТ /C. trachomatis/.
Основным методом терапии хламидийной инфекции является применение антибактериальных препаратов. При этом лечение в ряде наблюдений оказывается неудачным, что некоторые авторы трактуют как развитие резистентности клинических штаммов /C. trachomatis/.
Установлено, что /C. trachomatis/ нередко трансформируется в состояние персистенции, в котором практически не делится и не восприимчива к воздействию антибактериальных средств.
Для персистирующих микроорганизмов характерны изменения морфологии и экспрессии основных хламидийных агентов, уменьшение синтеза главных структурных компонентов (МОМР, белок клеточной стенки мол. массой 60 кДа и ЛПС). Одновременно отмечается непрерывный синтез белка теплового шока с мол. массой 60 кДа, который имеет важное значение в иммунопатогенезе персистирующей инфекции и сохранении постоянной воспалительной реакции вследствие антигенной перегрузки макроорганизма и инициирования запуска перекрестного аутоиммунного ответа.
Для элиминации /C. trachomatis/ применяют препараты, относящиеся преимущественно к 3 фармакологическим группам: макролидам, тетрациклинам, фторхинолонам.
Современные руководства (рекомендации) разделяют все препараты на 2 группы: рекомендуемые и альтернативные.
Рекомендуемые схемы обеспечивают наилучшее соотношение между необходимой эффективностью лечения и доказанной безопасностью применения.
Альтернативные схемы обеспечивают приемлемые результаты лечения при отсутствии возможности использования рекомендуемых схем в силу различных обстоятельств (индивидуальная непереносимость, возрастные ограничения, сопутствующие соматические заболевания, беременность, лактация и др.).
Самым последним руководством по ведению больных ИППП является CDC (США, 2006 г.), в соответствии с которым для элиминации /C. trachomatis/ используются следующие схемы лечения [2].
* *
*Рекомендуемые схемы
*/Азитромицин /1 г внутрь однократно
/или
Доксициклин/ по 100 мг 2 раза в день внутрь в течение 7 дней.
*Альтернативные схемы
*/Эритромицин /основание 500 мг перорально
4 раза в день в течение 7 сут,
или
/Офлоксацин/ 300 мг перорально 2 раза в день
в течение 7 сут,
или
/Левофлоксацин /500 мг 1 раз в день в течение 7 сут.
Результаты клинических исследований показали, что азитромицин и доксициклин обладают практически одинаковой высокой эффективностью (94,9 и 95,9% соответственно) в эрадикации инфекции [3]. Исследования проводились преимущественно в популяциях, когда имелась возможность последующего наблюдения за пациентами и соблюдения рекомендаций при 7-дневном курсе лечения доксициклином. Когда имеется возможность нарушений в проведении курсового лечения, несоблюдения режима приема препаратов и др., обоснованным является назначение азитромицина, однократная курсовая доза которого может быть проконтролирована врачом. В случае назначения азитромицина необходимо обязательно объяснить пациенту, что для его излечения требуется 7 дней, в течение которых необходимо воздерживаться от любых форм половых контактов.
Азитромицин одобрен для применения у лиц моложе 15 лет, что дает ему преимущество при лечении хламидийной инфекции у подростков, являющихся типичным примером популяции с низкой комплаентностью.
Азитромицин является первым представителем подкласса азалидов, несколько отличающихся по структуре от классических макролидов, полученным путем включения атома азота в 14-членное лактонное кольцо между 9 и 10-м атомами углерода. Данная структурная организация азитромицина обусловливает значительное повышение его кислотоустойчивости (в 300 раз по сравнению с классическим представителем макролидов эритромицином).
Механизм действия азитромицина обусловлен связыванием с 50S-субъединицей рибосомы микробной клетки и нарушением синтеза белка.
Подобно другим макролидам, азитромицин обладает в основном бактериостатическим эффектом, но благодаря способности создавать высокий уровень внутриклеточной концентрации на многие патогены, находящиеся внутри клеток, может действовать бактерицидно [4].
Важной фармакокинетической особенностью азитромицина является создание высоких и стабильных концентраций в тканях и органах репродуктивной системы даже при его однократном приеме. Так, через 24 ч после однократного приема азитромицина в дозе 1 г его уровень в ткани предстательной железы составляет 94 мг/л, через 48 ч – 54 мг/л и даже через 3 нед превышает минимальную подавляющую концентрацию (МПК) для /C. trachomatis/ [5]. Высокие концентрации азитромицина, превышающие МПК для /N. gonorrhoeae/, /C. trachomatis/ и /U. urealyticum/, создаются также в секрете простаты [6]. Уровень содержания азитромицина в цервикальном канале в первый день после приема 1 г однократно в 9,5 раза, через 7 дней – в 5,5 раза превышает его концентрацию в сыворотке крови [7]. Отмечено накопление антибиотика и в других органах малого таза у женщин [4].
К дополнительным достоинствам азитромицина следует отнести его хорошую переносимость и низкий уровень побочных эффектов (один из самых низких среди известных для макролидов).
Выбор препаратов для лечения хламидийной инфекции у беременных значительно ограничен, так как многие из них могут оказывать тератогенный или эмбрио- и фетотоксическое действие.
В соответствии с классификацией FDA (Food and Drug Administration, США) выделяют 5 классов безопасности лекарственных средств у беременных – А, В, С, D и Х [8]. Наиболее безопасным является класс А, наиболее опасным – класс Х (см. таблицу).
В соответствии с данной классификацией разрабатываются рекомендации применения антибактериальных средств во время беременности.
В руководстве CDC (2006 г.) азитромицин впервые включен в перечень рекомендуемых препаратов для лечения хламидийной инфекции у беременных.
* *
*Рекомендуемые схемы
*/Азитромицин /1 г внутрь однократно
или
/Амоксициллин/ 500 мг внутрь 3 раза в день в течение 7 сут.
*Альтернативные схемы
*/Эритромицин/ основание 500 мг внутрь 4 раза
в день в течение 7 сут,
или
/Эритромицин /этилсукцинат 400 мг внутрь
4 раза в день в течение 14 сут,
или
/Эритромицин/ этилсукцинат 800 мг 4 раза
в день в течение 7 сут.
В данном руководстве указано, что клинический опыт и результаты исследований продемонстрировали безопасность и эффективность азитромицина в однократной дозе 1 г при лечении хламидийной инфекции у беременных с рекомендацией провести контрольное обследование не ранее чем через 3 нед после лечения.
Результаты ряда сравнительных рандомизированных исследований подтверждают также высокую эффективность азитромицина при однократном пероральном приеме в дозе 1 г (97– 100%), значительное снижение частоты побочных эффектов (7,4% по сравнению с таковой у эритромицина – 38,8%), отсутствие неблагоприятного влияния на плод [9, 10]. В многоцентровом исследовании, включавшим 347 пациенток, микробиологическая излеченность при применении азитромицина была достигнута в 97% случаев, а клиническая – в 86% наблюдений. Таким образом, максимальная терапевтическая и экономическая эффективность в сочетании с хорошей переносимостью, удобством применения и безопасностью позволяют рассматривать азитромицин как препарат выбора при лечении урогенитального хламидиоза беременных.
Следует с помощью пациента, у которого выявлены /C. trachomatis/, уведомлять всех лиц, имевших с ним половой контакт за 60 дней до появления симптомов заболевания или до получения результатов лабораторного теста.
/
Литература
1. Kovass L, Nagy E, Berdik I et al. The frequency and role of Chlamydia trachomatis infection in premature labor. Int J Cynecol Obstet 1998; 62:
47–54.
2. MMWR Sexually Transmitted treatment Guidelines. 2006; 55: RR-11.
3. Lau C-Y, Qureshi AK. Azithromycin versus doxycycline for genital Chlamydial infections: A meta-analysis of randomized clinical trials. Sex Transm Dis 2002; 29: 497–502.
4. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. М., 2002.
5. LeBel M, Gregoire M, Vallee F et al. Prostate tissue concentrations following a single 1 gm dose of azithromycin. The 3rd International Conference on the Macrolides, Azalides and Streptogramins. Lisbon 1996;
Abstr. 4–15.
6. LeBel M, Bisson S, Allard S et al. Prostatic fluid and ejaculate penetration of single 1 g dose azithromycin. The 2nd International Conference on the Macrolides, Azalides and Streptogramins. Venice, 1994;
Abstr. 201.
7. Worm A-M, Osterling A. Azithromycin levels in cervical mucous and plasma after a single oral dose. The 2nd International Conference on the Macrolides, Azalides and Streptogramins. Venice, 1994; Abstr. 200.
8. Лекарственные средства. Справочник лекарственных средств, отпускаемых по рецепту врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи. Под ред. Р.У.Хабриева, А.Г.Чучалина. 2005; Вып. 2.
9. Adair CD, Gunter M, Stovall TG et al. Chlamydia in pregnancy: a randomized trial of azithromycin and erythromycin. Obstet Gynecol 1998;
91 (2): 165–8.
10. Wehben HA, Rugeirio RM, Skahem S, Lopes G. Single-dose azithromycin for Chlamydia in pregnant women. J Reprod Med 1998; 43 (6): 509–14.
Лечение пациента с хламидийной инфекцией должно сопровождаться лечением его сексуального партнера(ов), что является чрезвычайно важным для контроля над заболеваемостью, так как предотвращает реинфекцию. Кроме того, повторная хламидийная инфекция вызывает развитие таких воспалительных заболеваний органов малого таза, как эктопическая беременность, хронические тазовые боли и бесплодие. Следует учитывать, что сексуальные партнеры часто не предъявляют жалоб либо не обращают на них внимания, но данное обстоятельство не является основанием для отказа от лечения.



