 З. И. Левитская, Е. В. Перистая
З. И. Левитская, Е. В. Перистая
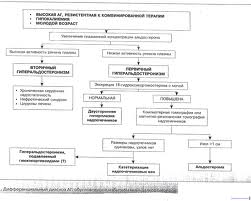
Гиперальдостеронизм — это синдром, обусловленный гиперсекрецией альдостерона надпочечниками. Здесь речь пойдет о первичном идиопатическом гиперальдостеронизме (ПИГА), который не зависит от регуляции со стороны ренин-ангиотензиновой системы, не связан с гормонально-активной опухолью альдостеромой. ПИГА обусловлен различными патогенетическими механизмами и морфологическими изменениями в обоих надпочечниках.
Впервые Foley в 1955 г. предположил, что нарушение водно-электролитного баланса может быть обусловлено гормональными изменениями на фоне внутричерепной гипертензии. Это мнение было подтверждено другими авторами (M. B. A. Oldstone, 1966; M. Greer, 1964; R. D. Gordone, 1995). Однако выявить причинно-следственную связь этих нарушений не удалось.
В дальнейшем, в ходе изучения патогенеза так называемой эссенциальной гипертонии, у ряда больных был диагностирован гипоренинемический гиперальдостеронизм, а у части этих пациентов наблюдалась гипокалиемия. Процент данного типа гипертонии к настоящему времени, согласно результатам ряда исследований, достигает 20–30% (R. D. Gordone, M. Stowasser, T. Tunny et al., 1994; G. P. Ross, E. Ross, E. Pavan et al., 1998). При этом, как правило, при обследовании надпочечников выявляется двусторонняя диффузная или мелкоузелковая гиперплазия. Однако механизм регуляции секреции альдостерона надпочечниками в подобных случаях и причины их гиперплазии оставались неясными. В то же время в литературе имеются указания на участие в синтезе и секреции альдостерона адренокортикотропного гормона (АКТГ), предсердного натрийуретического пептида, дофамина, серотонина. Эти предположения не лишены основания, так как проопиомеланокортин (ПОМК), который предположительно синтезируется в промежуточной доле гипофиза, является предшественником АКТГ и находится под влиянием таких нейромедиаторов гипоталамуса, как дофамин и серотонин (В. М. Кеттайл, Р. А. Арки, 2001). Поэтому можно предположить, что нарушения в гипоталамо-гипофизарной системе любого генеза (инфекции, травмы и др. причины) могут изменить нормальную гормональную регуляцию различных органов и тканей-мишеней. В результате развивается соответствующая клиническая картина, которая чаще всего трактуется как гипоталамический синдром с различными метаболическими и соматическими нарушениями.
Развитие гипоталамического синдрома исследователи связывали с выявленной внутричерепной гипертензией. Однако нарушение функции клубочковой зоны коры надпочечников с патологией гипоталамических структур не рассматривалось. Патогенез развития ПИГА оставался неясным.
Впервые нами в 2002 г. была опубликована работа (З. И. Левитская, М. И. Балаболкин, 2002) с описанием истории болезни пациентки 50 лет, у которой наблюдалось развитие дексаметазонзависимого ПИГА на фоне внутричерепной гипертензии после двух перенесенных операций в детском возрасте по поводу гнойного некротического мастоидита. Диагноз был поставлен через 40 лет от начала заболевания. В 2003 г. Weber и соавторы сообщили о двух женщинах 55 и 57 лет с длительным анамнезом заболевания, у которых ПИГА развился на фоне внутричерепной гипертензии. В обоих случаях имела место гиперплазия надпочечников. Weber и соавторы связывают патофизиологию данного заболевания с увеличением объема цереброспинальной жидкости, церебральным внутриклеточным отеком и/или увеличением внутримозгового объема крови. При этом патогенез заболевания остается под вопросом.
В 2002 г. у одной из пациенток мы, наряду с выявленными нарушениями водно-солевого обмена, обнаружили повышение в суточной моче содержания серотонина, 5-оксииндолуксусной кислоты (5-ОИУК), гистамина. Этот факт навел нас на мысль о причастности гипоталамо-гипофизарных структур к гиперплазии и гиперфункции клубочковой зоны коры надпочечников. Синдром ПИГА диагностируется поздно, так как заболевание длительное время протекает с нерезко выраженными клиническими симптомами, такими, как «мягкая» артериальная гипертония, увеличение массы тела, задержка жидкости. Поскольку у больных имеется артериальная гипертония, то назначение мочегонных препаратов препятствует своевременной диагностике нарушения водно-солевого обмена. Основными жалобами у этих больных являются головная боль, иногда довольно сильная, с тошнотой и рвотой, головокружение, периодически наблюдаются нарушения зрения, редко судороги с потерей сознания, иногда нарушение сердечного ритма, могут иметь место изменение поведенческих реакций и транзиторная гипергликемия. В связи с гетерогенностью жалоб больные часто обращаются к врачам различных специальностей, не получая должной оценки клинического состояния. В лучшем случае диагностируется гипоталамический синдром с нарушением жирового обмена и проводится симптоматическая терапия, в том числе и гипотензивная. Клинический эффект, как правило, оказывается неубедительным.
В связи с вышесказанным мы приводим анализ анамнестических, клинических, лабораторных данных 11 больных (1 мужчина и 10 женщин), которые находились под нашим наблюдением. Возраст больных колебался от 21 до 65 лет. У всех больных характерными симптомами явились жалобы на головную боль различной интенсивности и продолжительности, задержку жидкости при отсутствии отеков, увеличение массы тела — от 28 до 80 кг сверх нормы в течение нескольких лет, артериальную гипертонию с повышением артериального давления — у различных пациентов от 160/90 до 300/170 мм рт. ст. У 4 больных периодически возникал судорожный синдром с кратковременной потерей сознания. Иногда судороги сопровождались рвотой. У 2 больных наблюдалась полидипсия до 5–6 л/сут при суточном диурезе 1,0–1,5 л. Все больные задолго до развития клинической картины описываемого заболевания болели ангиной, гайморитом, отитом с развитием гнойного мастоидита либо имели черепно-мозговую травму (как правило, во время родов).
В связи с этим представляют интерес диагнозы, с которыми пациенты обратились к нам.
Больная Г., 42 г. Диагноз: синдром «пустого турецкого седла», эпилепсия. По поводу эпилепсии длительное время лечилась у психиатра.
Больная С., 29 лет. С 6 лет страдала артериальной гипертонией, внутричерепной гипертензией после родовой травмы. Больная В., 40 лет; больной Б., 40 лет. Диагноз: гипоталамический синдром пубертатного периода.
Больная К., 66 лет. Диагноз: гипоталамический синдром с нарушением водно-солевого обмена; синдром Пархона на фоне внутричерепной гипертензии.
Больная У., 46 лет. Диагноз: вегетососудистая дистония по гипертоническому типу.
Больная Б., 50 лет. Диагноз: артериальная гипертония, тяжелое течение.
Больная Г., 46 лет; больная З., 28 лет; больная Л., 30 лет.
Диагноз: ожирение; артериальная гипертония.
Анализируя анамнез заболевания, жалобы и клиническую картину, мы пришли выводу, что у обследуемых больных имеется гипоталамический синдром с нарушением жирового и водно-солевого обмена. Причем нарушение водно-солевого обмена связано с вторичной гиперплазией коры надпочечников и гиперсекрецией альдостерона. Кроме того, у всех пациентов были выявлены признаки внутричерепной гипертензии — по данным рентгенологического исследования. Причинами изменений на краниограммах, скорее всего, являлись перенесенные в детстве нейроинфекции, которые осложняют течение хронических воспалительных заболеваний носоглотки, а также черепно-мозговые травмы. С целью выявления нарушения водно-электролитного баланса были рекомендованы измерение массы тела утром и вечером, контроль суточного диуреза и артериального давления в различное время суток. Результат измерения массы тела показал, что разница между утренними и вечерними показателями составляла от 1,5 до 2,5 кг в сутки (при норме до 1,0 кг). Разница в количестве потребляемой и выделяемой жидкости колебалась от 0,5 до 2,5 л в сутки. Подъем артериального давления находился в прямой зависимости от задержки жидкости. Мы исследовали электролиты в суточной моче и крови (натрий, калий, кальций), ренин и альдостерон крови, серотонин, 5-ОИУК и суточную экскрецию гистамина в моче.
Полученные результаты исследования показали, что у 10 больных концентрация в крови калия и натрия оставалась в пределах нормы. И только у одной больной отмечалась незначительная гипокалиемия. В суточной моче результаты были более информативны: у 2 больных экскреция натрия с мочой оказалась в норме. У 9 пациентов отмечалось снижение суточной экскреции натрия, что свидетельствовало о задержке выделения натрия из организма. В анализах 3 больных, у которых исследовалась экскреция кальция с мочой, также отмечалась его задержка.
Исследования ренина крови показало нижнюю границу нормы у 3 больных, у остальных отмечалась гипоренинемия. Концентрация альдостерона в крови у 10 из 11 была умеренно повышена. В отношении суточной экскреции альдостерона с мочой были получены следующие результаты: в 10 случаях отмечалось повышение и еще в одном — нормальная экскреция альдостерона при снижении экскреции ренина. Что касается нейромедиаторов, то у 10 больных экскреция серотонина и 5-ОИУК с мочой была повышена, и только у одной пациентки отмечалось повышение суточной экскреции 5-ОИУК при нормальной экскреции серотонина. Компьютерная томография надпочечников выявила наличие двусторонней гиперплазии у 6 больных.
На основании полученных результатов всем больным был поставлен диагноз ПИГА на фоне внутричерепной гипертензии. Как уже сообщалось выше, одним из клинических вариантов ПИГА является дексаметазонзависимый гиперальдостеронизм. Возможно, данный вариант ПИГА связан с образованием ПОМК, который находится под влиянием серотонина и дофамина и одновременно является предшественником АКТГ. Кортиколиберин, стимулирующий синтез и секрецию АКТГ, из срединного возвышения выделяется одновременно с аргинин-вазопрессином и с разной степенью чувствительности подавляется глюкокортикоидами. С учетом вышесказанного для подавления секреции АКТГ при лечении больных мы использовали дексаметазон в дозе 0,25 мг на ночь. При этом учитывался не только АКТГ-подавляющий эффект препарата, но и его супрессивное влияние на серотонин и аргинин-вазопрессин.
Из 11 больных у 6 на фоне приема дексаметазона нормализовались показатели электролитного баланса, снизился уровень альдостерона и, самое главное, снизилось или нормализовалось артериальное давление. Масса тела у двух больных уменьшилась за 10 дней на 3 кг, еще одна больная за 20 дней похудела на 8 кг, другая — за 8 мес на 20 кг. Кроме того, у всех пациентов улучшилось общее состояние, исчезли судороги.
Для остальных больных подбиралась индивидуальная терапия с учетом рассмотренных выше клинико-патогенетических особенностей артериальной гипертонии данной категории больных. Предлагаемый антигипертензивный препарат должен воздействовать на ключевые патогенетические механизмы данного варианта артериальной гипертонии. С учетом задержки натрия у наших пациентов и повышенной экскреции калия препаратом выбора является верошпирон, который обладает антиальдостероновым эффектом. Нами препарат назначался в дозе от 25 до 150 мг/сут. Иногда было достаточно только монотерапии этим препаратом (у 3 больных). В двух случаях клинически значимого эффекта удалось добиться при использовании комбинации верошпирона и дексаметазона. Больным, у которых была снижена суточная экскреция кальция с мочой, проводилось лечение антагонистами кальция (кордафлекс ретард) с хорошим эффектом. Наряду с гипотензивными препаратами больным, не получавшим дексаметазон, назначался ацетазоламид (диакарб) 250 мг 2 раза в неделю. Данный препарат уменьшал внутричерепную гипертензию и положительно влиял на общее состояние пациентов. Препараты, улучшающие функцию и метаболический фон мозга, также показаны для данной категории больных. С учетом инсулинорезистентности возможно назначение больным с ожирением метформина (сиофор). В связи с выявлением у данной категории больных нарушений серотонинергической регуляции в гипоталамических структурах целесообразно назначение препаратов из группы сибутрамина (меридиа) в дозе от 10 до 15 мг в сутки. Фармакологическое действие данной группы препаратов заключается в ингибировании обратного захвата серотонина и норадреналина в ЦНС. Таким образом, ПИГА представляет собой сложную цепочку нарушений синтеза и секреции альдостерона со стороны гипоталамических структур, травмированных в результате какого-либо патологического процесса (инфекция, травма). Все это приводит к нарушению обмена нейромедиаторов (В. М. Кеттайл, Р. А. Арки, 2001). Изменения нейромедиаторных взаимодействий вызывают соответствующие нарушения нейроэндокринных процессов.
Последнее обстоятельство объясняет клиническую картину, которая требует анализа причинно-следственных связей, диагностического поиска, назначения патогенетической терапии.
З. И. Левитская, кандидат медицинских наук
Е. В. Перистая
ММА им. И. М. Сеченова, Москва
Источник: Издательство «Открытые системы»

Гинеколог Беркенгейм Михаил Леонидович
Профессор Беркенгейм. Лечение бесплодия, урологических и гинекологических заболеваний. ☎ +7(926) 221-14-39


